Los recientes anuncios de Pfizer/BioNTech y Moderna sobre los resultados de sus vacunas candidatas para COVID-19 son prometedores. Ambas vacunas de utilizan la misma aproximación para preparar al organismo ante un eventual contacto con el coronavirus SARS-CoV-2: utilizar ARNs mensajeros sintéticos con las instrucciones de una proteína viral. No obstante, existen diferencias en su composición, así como en su mantenimiento y protocolo de administración. Igualmente, en ambos casos, los ensayos clínicos siguen en marcha por lo que los resultados no son los definitivos, y la información sobre eficacia y seguridad disponible hasta el momento procede de las notas de prensa emitidas por las empresas.
De molécula intermediaria a opción terapéutica
Las vacunas de ARN siguen la estrategia de utilizar el ARN, molécula menos permanente que el ADN, como herramienta terapéutica. Esta aproximación se basa en que la introducción de un ARN mensajero sintético en una célula la convierte en productora de la proteína en cuestión. De este modo,si se administra un ARN que codifica para una proteína terapéutica para tratar una enfermedad, las propias células se convertirán en pequeñas fábricas de producción del fármaco.
Pese a la sencillez de su planteamiento, el desarrollo de fármacos basados en ARN ha tenido que hacer frente a varios retos para poder llegar a la fase de evaluación clínica. Uno de ellos es que el ARN sintético puede detectarse como un agente extraño en las células y ser degradado, activando mecanismos inmunitarios que comprometen su objetivo terapéutico de producir proteína y pueden representar un riesgo para los posibles pacientes. La resolución de este problema llegó de la mano de Katalin Karikó y Drew Weissman en 2005 y fue un factor decisivo a favor de la investigación del ARN como molécula terapéutica. Además impulsó la creación de empresas como Moderna y BioNTech, dirigidas a desarrollar fármacos basados en ARN mensajero. Ambas empresas tienen varios productos en fase de ensayos clínicos, pero todavía no han recibido aprobación para ninguno.
Cómo funcionan las vacunas de ARN
Al igual que el resto de vacunas, el objetivo de las vacunas de ARN es prevenir la infección, entrenando al organismo para que sea capaz de reconocer al organismo infeccioso y actuar frente a él en caso de entrar en contacto. Las vacunas de ARN proporcionan a las células las instrucciones para producir una proteína viral que induce una respuesta inmunitaria frente al agente infeccioso concreto y favorece que el organismo genere una memoria inmunitaria que lo proteja en el futuro.
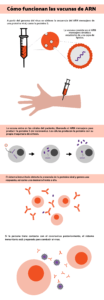
Una ventaja de este tipo de vacunas es que su diseño está basado en el genoma del agente infeccioso, en este caso el coronavirus, y no es necesario trabajar con él en el laboratorio. Esta característica hizo posible que en el momento en el que se obtuvo el genoma del coronavirus SARS-CoV-2, empresas como Moderna o BioNtech comenzaran a desarrollar sus vacunas candidatas. En el caso de Moderna, por ejemplo, el primer lote de vacuna para ser testada a nivel clínico fue completado el 7 de febrero, apenas un mes después de la publicación del genoma de SARS-CoV-2. La primera inoculación de esta vacuna a una persona fue el 16 de Marzo.
Las vacunas diseñadas por Moderna y BioNTech
Las vacunas diseñadas por Moderna y BioNTech contienen ARN mensajero que codifica una forma de la proteína S del coronavirus. Esta proteína tiene un papel relevante en la entrada del virus a las células por lo que dirigir al sistema inmunitario frente a ella es una estrategia general de múltiples vacunas, más allá de las de ARN.
Tanto mRNA-1273, la vacuna de Moderna, como BNT162b2, la vacuna diseñada por BioNTech, consisten en una partícula de lípidos que contiene en su interior el ARN codificante de una versión estabilizada de la proteína S. Este ARN contiene dos cambios en la secuencia proteica resultante que llevan a que la proteína S se encuentre de forma permanente en su conformación previa a la unión con el receptor, conformación que es la que refleja mejor la presencia del virus real con el que tendrán que interaccionar los anticuerpos neutralizadores generados por el organismo. El ARN codificante que incluye BNT162b2, tiene además algunos de sus nucleósidos modificados, característica que en estudios previos se ha observado que reduce la degradación del ARN terapéutico.
La cobertura lipídica de las vacunas favorece su entrada a las células y una vez liberado el ARN en el interior, la propia maquinaria de la célula se encarga de producir la proteína S.
Tanto la vacuna de Moderna como la de BioNTech requieren dos dosis para inducir protección. En el caso de Moderna, las dosis están separadas por 28 días, mientras que en la vacuna de BioNTech son 21 días.
Para poder hacer frente a las necesidades de producción y distribución de la vacuna para la COVID-19 BioNTech se ha asociado con la farmacéutica Pfizer. Moderna realiza sus ensayos clínicos en colaboración con el Instituto Nacional de Alergias y Enfermedades Infecciosas, parte del Instituto Nacional de Salud de EE.UU., y está financiada por la Autoridad de Investigación y Desarrollo Biomédico Avanzado, del Departamento de Salud y Servicios Humanos.
Cómo se están probando las vacunas y qué se sabe de su eficacia
Tanto mRNA-1273 como BNT162b2 han pasado por estudios clínicos de fase 1 y fase 2 que hacen una primera valoración de la seguridad, tolerabilidad y eficacia potencial de las vacunas.
En la actualidad, ambas vacunas se encuentran en ensayos clínicos de fase 3, que permiten evaluar a mayor escala la eficacia de un fármaco o vacuna. En estos ensayos se inocula la vacuna o un placebo a miles de voluntarios participantes y se espera a que un número significativo se infecte de forma natural con el virus. Si la vacuna confiere protección frente al virus se espera que el número de personas que reciben la vacuna y se han contagiado sea significativamente menor que el número de personas que reciben el placebo y se infectan. La eficacia en las condiciones del ensayo se estima a partir de cuantos participantes que recibieron placebo se han contagiado respecto a los que recibieron la vacuna, todos ellos haciendo vida normal, con medidas de protección actuales. Tanto en la vacuna de Pfizer/BioNTech como en el caso de Moderna, la eficacia ha sido evaluada por comités externos a ambos estudios.
Con los datos disponibles hasta la fecha, Pfizer y BionTech anunciaron la semana pasada que su vacuna tiene un 90% de eficacia. Estos resultados preliminares derivan de los primeros 94 participantes del ensayo que se han contagiado con coronavirus de forma natural al menos una semana después de la segunda dosis.
En total, el ensayo de Pfizer y BioNTech contará con 43.538 participantes, de los que 38 955 han recibido las dos dosis necesarias hasta el momento. Los responsables del estudio han anunciado que realizarán un análisis final cuando se alcancen los 164 infectados.
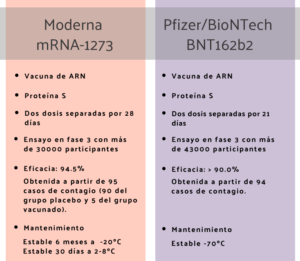
Por otra parte, Moderna ha anunciado esta semana que su vacuna candidata tiene casi un 95% de eficacia, según los primeros resultados de un ensayo con más de 30 000 personas. En este caso, la eficacia ha sido calculada a partir de 95 casos de contagio ocurridos dos semanas tras la segunda dosis de vacuna, 90 correspondientes al grupo placebo y 5 al grupo que recibió la vacuna. En la nota de prensa que acompaña al anuncio de Moderna también se hace referencia a los primeros datos sobre la protección de su vacuna frente a los casos más graves de COVID-19: de los 11 casos graves evaluados, todos habían recibido el placebo. Moderna también indica que la mayoría de los efectos adversos asociados a la vacuna fueron moderados o leves y en general de corta duración.
Hasta el momento la información sobre la eficacia de ambas vacunas en los ensayos en fase 3 deriva de las notas de prensa presentadas por ambas empresas. Los resultados de las fases de investigación anteriores fueron publicados en diversas revistas científicas y habrá que esperar a que se realicen los análisis finales para disponer de información más detallada.
Estado actual de las vacunas de Pfizer/BioNTech y Moderna
La vacuna BNT162b2 de Pfizer/BioNTech se sigue evaluando en ensayos en fase 3 en EE.UU., Alemania, Argentina, Brasil, Sudáfrica y otros países. También se ha anunciado la aprobación para comenzar ensayos de fase 2 en china, en colaboración con Fosun Pharma. De momento, esta vacuna ha recibido la designación de “Vía Rápida” de la Administración de Medicamentos y Alimentos de EEUU y se ha iniciado el proceso de solicitud para la Agencia Europea del Medicamento.
Albert Bourla, presidente y consejero delegado (CEO) de Pfizer, ha señalado que esperarán a tener los datos de seguridad de la vacuna correspondientes a una mediana de dos meses tras la segunda dosis de vacuna para solicitar la Autorización de Uso de Emergencia de la FDA. Según sus estimaciones esto será alrededor de la tercera semana de noviembre. “Eficacia, seguridad y producción consistente son los tres requisitos que son necesarios antes de ser capaces de solicitar la autorización”, indica Bourla en la página web de Pfizer.
La vacuna mRNA-1273 de Moderna se está evaluando en ensayos de fase 3 en EE.UU. La nota de prensa de Moderna indica que ante los resultados obtenidos se solicitará una Autorización de Uso de Emergencia por parte de la FDA en las próximas semanas. También se enviarán solicitudes a otras agencias reguladoras, incluyendo la Agencia Europea del Medicamento.
Cuestiones que quedan por resolver sobre las vacunas de Pfizer/BioNTech y Moderna
Los resultados preliminares de ambas vacunas son positivos y muy prometedores, especialmente, si se tiene en cuenta que las dos vacunas se están evaluando en personas de varios grupos de edad y comunidades diversas. No obstante, quedan todavía algunas cuestiones por resolver.
Lo primero de todo será completar los ensayos clínicos en marcha, para obtener la información más completa posible sobre la seguridad, eficacia y efectos de las vacunas.
Por ejemplo, un aspecto a estudiar el efecto a largo plazo de ambas vacunas en el organismo, tanto a nivel de producción continuada de proteína S como a nivel de protección frente a la infección. Una de las ventajas para plantear la utilización de ARN terapéutico, más allá de las vacunas, es que se trata de una molécula menos estable y no modifica el ADN de las células, aunque sí produzca una respuesta en el interior de la célula. Hasta el momento no hay datos de durante cuánto tiempo se produce proteína viral tras la administración de las vacunas de ARN o de la duración de la protección inducida, lo que deberá ser investigado en los participantes de los ensayos.
Otra cuestión interesante relativa a cualquier vacuna que se plantee para COVID-19 es cómo se producirán, mantendrán y distribuirán a gran escala las dosis de vacunas necesarias para hacer frente a la pandemia.
Respecto a la producción, tanto Pfizer/BioNTech como Moderna señalan que esperan producir aproximadamente 20 millones de dosis para finales de 2020. Las cifras de producción para 2021 podrían alcanzar los 1000 millones de dosis en el caso de Moderna y 1300 millones en el caso de Pfizer/BioNTech. Teniendo en cuenta la necesidad de dos dosis por persona, potencialmente podría vacunarse a alrededor de 1000 millones de personas entre ambas vacunas. Diversos países han iniciado acuerdos para obtener vacunas.
En cuanto a la distribución y almacenamiento, la vacuna de Moderna ofrece ciertas ventajas sobre la de Pfizer, ya que es estable a temperatura ambiente durante 12 horas, suficiente para plantear una vacunación en diferentes localizaciones, y puede mantenerse en nevera (a 2-8ºC) durante 30 días, lo que favorece su almacenamiento en centros de salud. Para el envío y acumulación a gran escala la vacuna se mantiene estable a temperaturas de -20ºC, correspondientes a un congelador común, durante 6 meses. La vacuna de Pfizer/BioNTech requiere temperaturas de -70ºC para su almacenamiento, lo que puede representar un problema grave para su distribución.
La situación de urgencia impuesta por la pandemia de COVID-19, que ya se ha cobrado más de un millón de muertes en todo el mundo, ha acelerado la maquinaria de diseño y producción de vacunas de tal forma que, en apenas un año ya se dispone de varias candidatas con gran potencial. Si los resultados de las vacunas de Pfizer/BioNTech y Moderna en cuanto a seguridad y eficacia se mantienen, su repercusión irá más allá del gran logro que supondría poner un freno a la pandemia. La aprobación de cualquiera de las dos vacunas, representaría la primera aprobación de un fármaco basado en ARN mensajero y confirmaría las expectativas del potencial del ARN mensajero como herramienta terapéutica que llevan años impulsando a diferentes equipos de investigación.
Fuentes:
Moderna’s COVID-19 Vaccine Candidate Meets its Primary Efficacy Endpoint in the First Interim Analysis of the Phase 3 COVE Study. https://investors.modernatx.com/news-releases/news-release-details/modernas-covid-19-vaccine-candidate-meets-its-primary-efficacy
Pfizer and BioNTech Announce Vaccine Candidate Against COVID-19 Achieved Success in First Interim Analysis from Phase 3 Study. https://www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-announce-vaccine-candidate-against
A Phase 1/2/3 Study to Evaluate the Safety, Tolerability, Immunogenicity, and Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Individuals. https://www.pfizer.com/science/coronavirus
BioNTech and Pfizer Initiate Rolling Submission to European Medicines Agency for SARS-CoV-2 Vaccine Candidate BNT162b2. https://biontechse.gcs-web.com/news-releases/news-release-details/biontech-and-pfizer-initiate-rolling-submission-european
Artículos científicos de ensayos de fase 1 o 2 de las vacunas:
Walsh EE, et al. Safety and Immunogenicity of Two RNA-Based Covid-19 Vaccine Candidates. N Engl J Med. 2020 Oct 14:NEJMoa2027906. doi: 10.1056/NEJMoa2027906.
Anderson EJ, et al. Safety and Immunogenicity of SARS-CoV-2 mRNA-1273 Vaccine in Older Adults. N Engl J Med. 2020 Sep 29:NEJMoa2028436. doi: 10.1056/NEJMoa2028436.
PUBLICADO por Amparo Tolosa EN: GENOTIPIA






¿Qué te pareció este artículo? Deja tu opinión: